Conotoxinas
Tipos de conotoxinas
O CDC inclui as conotoxinas numa classificação ampla denominada “Toxinas seleccionadas de baixo peso molecular”, em oposição às “Toxinas proteicas” com elevado peso molecular.
As conotoxinas são um grupo complexo de químicos constituídos por 12-40 resíduos de aminoácidos, formando moléculas peptídicas compactas, das quais são conhecidas mais de 2000 variações[1].
Estas caracterizam-se por um elevado conteúdo em resíduos de cisteína (geralmente 4 ou 6) em posições bem definidas. A presença desta elevada percentagem de cisteína confere às conotoxinas uma rigidez absolutamente crucial para a sua actividade biológica óptima.
Os resíduos de cisteína foram amplamente conservados ao longo da evolução do género, enquanto que os aminoácidos apresentam uma enorme variabilidade, não sendo decisivos para a actividade destes compostos. Este complexo mecanismo genético permitiu uma diversificação extraordinária das conotoxinas[2].
 Figura 1- Classificação e actividade biológica das conotoxinas[1].
Figura 1- Classificação e actividade biológica das conotoxinas[1].
ω-conotoxinas
Os canais de Cálcio (Ca2+) dependentes da voltagem são mediados por um influxo de Ca2+ em resposta a uma despolarização. Consituem complexos proteicos heteroméricos com quatro ou cinco subunidades diferentes. A sua diversidade fisiológica e farmacológica é devida principalmente às diferentes propriedades da subunidade α1 formadora do poro selectivo para o Ca2+.
Estas conotoxinas provaram ser muito valiosas, não só como ferramentas de investigação, mas também como novas terapêuticas potenciais para o tratamento da dor crónica[3].
As ω-conotoxinas são péptidos de 24-30 aminoácidos com três ligações dissulfeto[4].
Como em outras classes de conotoxinas, foram caracterizadas múltiplas isoformas de ω-conotoxinas com grandes diferenças nas sequências de aminoácidos[3]:
- GVIA do C. geographus;
- MVIIA, MVIIIV e MVIID do C. magus;
- CNVIIA do C. consors;
- CVID do C. catus.

Figura 2- Estrutura da ω-conotoxina (RMN)[5].
Por exemplo, a ω-MVIIA é altamente específica para o canal de Ca2+ tipo N, enquanto que a ω-MVIIC tem como alvo preferencial os canais tipo P/Q[3].
Por outro lado, as GVIA, GVIB e GVIC bloqueiam a junção neuromuscular do músculo esquelético, actuando através do bloqueio dos canais de cálcio sem interferirem com os potenciais de acção celulares. A toxina GVIA parece bloquear os canais do tipo L e N nos neurónios, mas só tem efeito nos canais do tipo N a nível muscular. Esta resposta pode ser muito útil na identificação e manipulação da modulação dos canais de cálcio[4].
Os canais de cálcio são alvos potenciais para terapêuticas que visam o tratamento directo da dor crónica, dano cerebral isquémico, enxaqueca e algumas formas de epilepsia e ataxia[3].
μ-conotoxinas
Estão descritas na literatura três famílias de conotoxinas, que actuam nos canais de sódio dependentes de voltagem (VGSCs), causando tanto inibição (µ e µO-conotoxinas) como inactivação (δ-conotoxinas).
Estas são as únicas toxinas polipeptídicas que se ligam ao local 1 nos VGSCs, um dos vários locais de ligação da toxina identificado nesses canais.
A subunidade α formadora de poro de cada VGSC consiste em quatro domínios homólogos, cada um contendo seis hélices transmembranares S1-S6. Ao local 1, localizado na superfície extracelular deste poro, ligam-se a tetrodotoxina alcalóide guanidina (TTX) e a saxitoxina, bem como as µ-conotoxinas.
Dos nove subunidades a clonadas até à data de mamíferos, pelo menos três, NaV1.5, NaV1.8 e NaV1.9, podem ser classificadas como TTX-resistentes. Os locais de ligação para a TTX e µ-conotoxinas sobrepõem-se, mas não são idênticos.
As µ-conotoxinas contêm 22-25 resíduos, com seis resíduos de Cys. As µ-conotoxinas GIIIA e GIIIB do C.geographus são as melhores caracterizadas. A GIIIA bloqueia selectivamente o músculo esquelético dos canais de Na+ (Nav1.4), tendo afinidade significativamente inferior para os outros subtipos de canais de Na+.
Outra µ-conotoxin, a PIIIA do C.purpurascens também tem uma forte preferência para o subtipo do músculo esquelético, mas pode bloquear outros subtipos TTX-sensíveis, embora com menor afinidade.
Uma nova µ-conotoxina, a SmIIIA, do C.stercusmuscarum, bloqueia os VGSCs TTX-resistentes em gânglios da raiz dorsal e simpática de sapos, mas tem pouco efeito em correntes neuronais TTX-sensíveis. Desta forma, a SmIIIA representa o primeiro antagonista específico dos canais de Na+ TTX-resistentes[3].
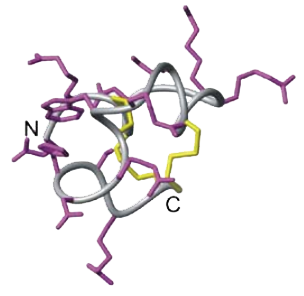
Figura 3- Estrutura da μ-conotoxina (RMN)[3].
κ-conotoxinas
As κ-conotoxinas bloqueiam os canais de potássio (K+), apresentando uma especificidade bastante elevada. Estes canais são importantes não só para a fase de repolarização do potencial de acção, mas também na definição do potencial de repouso da membrana, e possuem uma variedade de propósitos especiais numa gama ampla de tipos de células.
São conhecidas várias famílias de canais de K+ dependentes da voltagem (Kv1.x, Kv2.x), cada um com a α-subunidade contendo seis domínios transmembranares. A região entre o quinto e sexto segmento transmembranar constitui a via de condução iónica, com quatro subunidades que se juntam para formar um canal funcional, que pode ser homomérico (quatro subunidades idênticas) ou heteromérico (duas ou mais α-subunidades diferentes).
Os búzios cone possuem muitas famílias diferentes de péptidos que têm como alvos os canais de K+, embora, actualmente, o intervalo farmacológico e especificidade de qualquer família, particularmente em sistemas de mamíferos, é bastante indefinido.
Estudos realizados em camundongos, na qual foi administrada uma injecção da κ-conotoxina PVIIA, que originou sintomas excitatórios, demonstraram que o Kv1.2 é um alvo de baixa afinidade para a κ-conotoxina M-RIIIK. Este peptídeo apresenta também um efeito cardioprotector em modelos animais com infarte do miocárdio decorrente de isquemia.
Claramente, a disponibilidade de novos ligandos dos canais de K+ provenientes da espécie Conus está longe de ser esgotada. Na verdade, a recente demonstração de que uma κ-conotoxina que actua ao nível dos canais de K+ tem efeitos cardioprotectores, demonstra o potencial terapêutico considerável por explorar neste grupo de conotoxinas[3].

Figura 4-Estrutura da κ-conotoxina PVIIA (RMN)[6].
α-conotoxinas
As α-conotoxinas estão entre os primeiros conopéptidos caracterizados. Os receptores nicotínicos funcionais são complexos pentaméricos. As subunidades podem associar-se em receptores homopentaméricos funcionais (ex. subunidades α7, α8 e α9), as quais representam a minoria dos vertebrados.
As α-conotoxinas têm como alvo todas as classes de receptores nicotínicos descritos previamente. A subfamília das conotoxinas α3/5, são as α-conotoxinas maioritárias em diversos venenos de Conus do grupo piscívoro e são todas direccionadas para o subtipo do receptor nicotínico do músculo.
Como um grupo, as conotoxinas α3/5 são mais especificas para o nAChR do músculo que outros ligandos conhecidos. Muitas são altamente especificas para apenas um dos dois locais de ligação do ligando. Múltiplas α3/5 conotoxinas, codificadas por genes diferentes, mas todas paralisantes para o peixe, são encontradas frequentemente num único veneno. Isto implica alguma complexidade ainda por definir dos nAChRs neuromusculares da presa.
A extensa e amplamente distribuída subfamília α4/7 tem como alvos todas as classes de receptores nicotínicos. A sua especificidade para o alvo é dependente da sua sequência de aminoácidos, visto que apenas algumas substituições causam alterações na especificidade e afinidade para o alvo.
A elevada especificidade para o alvo das α-conotoxinas que actuam nos canais dos mamíferos surge porque a isoforma de um receptor nicotínico de um mamífero tem uma sequência muito semelhante àquela hómologa nos peixes[3].
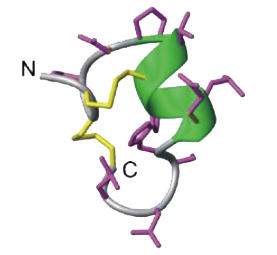 Figura 5-Estrutura da α-conotoxina MII[3].
Figura 5-Estrutura da α-conotoxina MII[3].
μO- e δ-conotoxinas
Estas conotoxinas são usualmente péptidos hidrofóbicos que pertencem à superfamília O, com um padrão de ligações de dissulfureto.
As µO-conotoxinas inibem a condução dos canais de sódio, assim como as µ-conotoxinas, mas não interagem com o local 1. Até agora, o mecanismo de interacção com os canais de sódio não é compreendido.
A µO-MrVIA e a µO-MrVIB são dois péptidos estreitamente relacionados com o C. marmoreus. A µO-MrVIA bloqueia o canal Nav1.2 e parece bloquear os canais de sódio TTX-sensíveis e –insensíveis. A MrVIB inibe potencialmente o canal de sódio TTX-resistente Nav 1.8, e exibiu actividade analgésica potente e duradoura em ratos.
As δ-conotoxinas bloqueiam a inactivação rápida das correntes de sódio, um dos mecanismos chave responsáveis pela forma e duração dos potenciais de acção. Estes resultados, no estado híper-excitado das células afectadas, pode eventualmente levar à superexcitação massiva eléctrica do organismo completo. A ligação extracelular destas conotoxinas parece afectar eventos na parte intracelular do canal de sódio importantes para a activação rápida.
As δ-conotoxinas têm o mesmo quadro de cisteina que as µO- e pertencem à mesma superfamília O.
Por exemplo, a conotoxina δ-EVIA do C.ermineus afecta diversos subtipos de canais de sódio neuronais do rato, mas não afecta os subtipos do músculo; os seus efeitos excitatórios actuam sinergicamente com o péptido k-PVIIA, um bloqueador dos canais de potássio, resultando na imobilização quase imediata da presa[3].
Bibliografia:
[1] https://www.aristatek.com/Newsletter/MAY08/TechSpeak.pdf, acedido a 16-05-2011.
[2] Conotoxina. Spira, 2001, Vol. 1, No. 1, 7-11.
[3] Norton R,Olivera B. Conotoxins down under.Toxicon 48 (2006), 780–798.
[4] https://grimwade.biochem.unimelb.edu.au/cone/index1.html, acedido a 26-05-2011.
[5] https://www.pdb.org/pdb/explore/explore.do?structureId=1TT3, acedido a 26-05-2011.
[6] https://www.pdb.org/pdb/images/1kcp_asym_r_500.jpg, acedido a 26-05-2011.

